Title Page
-
Organisme audité
-
Date début d'audit
-
Date fin d'audit
-
Type d'audit
-
Auditeur
-
Signature
Informations audit
Coordonnées de l'organisme
-
Organisme audité
-
Adresse
Informations sur l'audit
-
Nombre de curistes par an
-
Existence d'un laboratoire interne d'analyse intégré au périmètre
-
Analyses réalisées au titre de la partie principale de la surveillance par le laboratoire interne ?
-
Référentiel de l’audit
- Aquacert HACCP thermalisme v1 du 14 juin 2011
- Aquacert Spa v0
-
Sites concernés
Libellé du certificat
-
"Système de Management de la Sécurité Sanitaire des produits et dérivés thermaux"
-
Produits concernés
- EMN
- Boue (illutations ou bains)
- Cataplasmes
- Gaz thermal
- Baume de massage à base d'EMN
- Conferves / Algues
- Compresses thermales
- Eaux mères
Autres informations
Confidentialité
-
Le contenu de ce rapport, ainsi que toutes les notes prises durant cet audit sont traités de manière strictement confidentielle et ne seront divulgués à aucune autre tierce partie sans accord préalable écrit du client, sauf aux autorités d’accréditation compétentes lorsqu’elles l’exigent.
Résumé de l'audit
Points saillants
-
Principaux points forts identifiés lors de l'audit
-
Principaux points de progrès identifiés lors de l'audit
Plan d'audit
-
Plan de l'audit AQUACERT
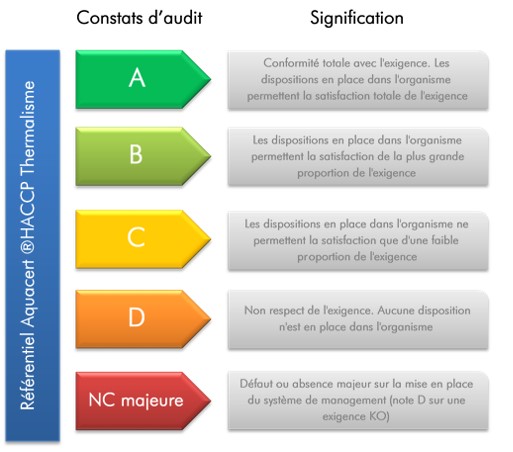
Gradation des écarts
Usage de la marque
-
L'usage de la marque est conforme aux règles d'usage de la marque.
-
Le certifié communique sur sa certification Aquacert sur son site web, en apposant son logo personnalisé, et en insérant un lien vers http://www.aquacert-certification.com/
Direction
4.1.1 - RESPONSABILITES - Responsabilité de la Direction
-
La direction doit s'assurer que les responsabilités et autorités sont définies et communiquées au sein de l’organisme.
- A
- B
- C
- D
- NA
- NE
-
RESPONSABILITES DE LA DIRECTION La direction doit nommer un membre de l’encadrement qui aura la responsabilité et l’autorité pour : - assurer que les procédures nécessaires au système de management de la sécurité des produits thermaux sont établies, mises en œuvre et entretenues ; - rendre compte à la direction du fonctionnement du système de management de la sécurité des produits thermaux et de tout besoin d’amélioration.
- A
- B
- C
- D
- NA
- NE
-
COMMUNICATION INTERNE La direction doit assurer que des processus appropriés de communication sont établis au sein de l’établissement et que la communication concernant l’efficacité du système de management de la sécurité des produits thermaux et la qualité des produits a bien lieu.
- A
- B
- C
- D
- NA
- NE
4.5.3 - INFORMATION AU PERSONNEL ET AUX CURISTES - Ecoute client (/ patient)
-
L’établissement doit déterminer et mettre en œuvre des dispositions efficaces de communication avec les curistes sur les informations relatives aux produits. Par exemple, il est important de mettre en œuvre un système pour recueillir les remarques et attentes des curistes afin d’en assurer le traitement.
- A
- B
- C
- D
- NA
- NE
7.5.0 - REVUE DU SYSTEME
-
La direction doit, à intervalles planifiés, revoir le système de management de la sécurité des produits thermaux de l’établissement pour assurer qu’il demeure pertinent, adéquat et efficace.
- A
- B
- C
- D
- NA
- NE
-
Cette revue doit comprendre l’évaluation des opportunités d’amélioration et du besoin de modifier le système.
- A
- B
- C
- D
- NA
- NE
-
Lors de la revue du système de management de la sécurité des produits thermaux, les informations à analyser doivent comprendre entre autres : - les résultats des audits ; - les retours d’information des curistes ; - le fonctionnement des process et la conformité des produits ; - les actions préventives et correctives ; - les actions issues des revues de direction précédentes ; - les changements pouvant affecter le système HACCP (notamment les modifications des process, d’équipement, de matière premières,…).
- A
- B
- C
- D
- NA
- NE
-
A l'issue de la revue, des décisions et actions, assorties d'échéances, doivent être prises et enregistrées dans un compte-rendu.
- A
- B
- C
- D
- NA
- NE
Organisation médicale
4.1.2 Responsabilités du Corps médical (établissements thermaux uniquement)
-
Les médecins exerçant en établissement thermal doivent signer une convention ou contrat précisant les locaux et matériels mis à leur disposition. Ces conventions doivent aussi définir les obligations respectives de chacun et préciser les moyens permettant aux médecins de respecter les dispositions du code de déontologie. Les médecins liés par convention restent responsables de leurs actes et devoirs, en particulier pour l’entretien de leur matériel.
- A
- B
- C
- D
- NA
- NE
-
Le corps médical doit effectuer une surveillance des curistes préalablement à la cure et pendant celle-ci. Cette surveillance concerne notamment : - les curistes présentant des plaies ou une affection quelconque (non prescription de certains soins à risque et pouvant contaminer les autres curistes, obligation de porter des pansements imperméables,…); - les curistes faisant l’objet de contre-indications.
- A
- B
- C
- D
- NA
- NE
-
Un médecin doit être attaché à chaque établissement thermal en qualité de directeur ou de conseiller technique. A défaut et provisoirement, un médecin praticien de la station doit assurer la surveillance médicale de l'établissement.
- A
- B
- C
- D
- NA
- NE
4.1.3 Responsabilité des autres intervenants (établissements thermaux uniquement)
-
Un infirmier doit se trouver en permanence à l'établissement pendant les heures de cure (minimum un par établissement). Le personnel infirmier fait le lien entre les médecins et les curistes et doit s’assurer que les curistes restent aptes à suivre leur cure. Un registre de soin précisant notamment le cas de curistes "arrêtant la cure" doit être tenu à jour. Ils ne peuvent pas réaliser d’actes médicaux.
- A
- B
- C
- D
- NA
- NE
HACCP / Risques
5.2.2 PRÉPARATION AU DÉPLOIEMENT HACCP - Décrire les produits thermaux
-
Tous les ingrédients et les matériaux en contact avec le produit et/ou dérivé doivent faire l’objet d’une description documentée contenant par exemple : - les caractéristiques biologiques, chimiques et physiques ; - la composition des dérivés composés y compris les additifs et les adjuvants de fabrication ; - l’origine ; - la méthode de production ; - les méthodes de livraison et le conditionnement ; - les conditions de stockage et la durée de vie ; - la préparation et/ou la manutention avant l’utilisation ou la transformation ;
- A
- B
- C
- D
- NA
- NE
-
Les caractéristiques des produits et dérivés thermaux doivent faire l’objet d’une description documentée contenant par exemple : - les noms des produits et/ou dérivés thermaux ou une identification similaire ; - L’usage prévu pour les produits et/ou dérivés thermaux et les principaux risques associés à cet usage en fonction des caractéristiques des personnes soignées et/ou utilisateurs; - la composition ; - les caractéristiques biologiques, chimiques et physiques pertinentes pour la sécurité de produits et/ou dérivés thermaux ; - la durée de vie et les conditions de stockage prévues ; - le conditionnement ; - l’étiquetage relatif à la sécurité des produits et/ou dérivés thermaux et/ou les instructions pour la manutention, la préparation et l’utilisation ; Les descriptifs doivent être tenus à jour en cas de modification des caractéristiques des produits et/ou dérivés.
- A
- B
- C
- D
- NA
- NE
5.2.3 PRÉPARATION AU DÉPLOIEMENT HACCP - Construire les diagrammes de process
-
Des diagrammes doivent être préparés pour les différents produits thermaux et process associés. Les diagrammes doivent fournir des informations concernant l’éventualité de survenue, d’augmentation ou d’introduction de dangers liés à la sécurité des produits thermaux. Les diagrammes doivent être clairs, précis et suffisamment détaillés.
- A
- B
- C
- D
- NA
- NE
5.2.4 PRÉPARATION AU DÉPLOIEMENT HACCP - Confirmer le diagramme sur le site
-
L’équipe HACCP doit vérifier la précision des diagrammes et s’assurer qu’une version mise à jour est disponible sur le site.
- A
- B
- C
- D
- NA
- NE
-
Les diagrammes vérifiés doivent être conservés en tant qu’enregistrements.
- A
- B
- C
- D
- NA
- NE
5.3.1 DÉPLOIEMENT DE LA MÉTHODE HACCP - Identifier les dangers potentiellement liés à chaque étape des process
-
Tous les dangers pouvant affecter la sécurité des produits thermaux doivent être identifiés à chaque étape des différents process. Le résultat de la détermination des dangers doivent faire l’objet d’un enregistrement.
- A
- B
- C
- D
- NA
- NE
5.3.2 DÉPLOIEMENT DE LA MÉTHODE HACCP - Procéder à l’évaluation des dangers
-
Chaque danger lié à la sécurité des produits thermaux doit être évalué selon sa gravité en termes d’effets néfastes sur la santé et de sa probabilité de survenue.
- A
- B
- C
- D
- NA
- NE
-
La méthodologie utilisée doit être décrite et les résultats de l’évaluation des dangers doivent faire l’objet d’un enregistrement.
- A
- B
- C
- D
- NA
- NE
5.3.3 DÉPLOIEMENT DE LA MÉTHODE HACCP - Définir et valider les mesures de maîtrise des dangers identifiés
-
Sur la base de l’évaluation des dangers, des mesures de maîtrise permettant de prévenir, d’éliminer ou de réduire ces dangers liés à la sécurité des produits thermaux à des niveaux acceptables définis doivent être sélectionnées.
- A
- B
- C
- D
- NA
- NE
5.3.4 DÉPLOIEMENT DE LA MÉTHODE HACCP - Identification des points critiques pour la maîtrise (CCP) (KO)
-
L’équipe HACCP doit déterminer, pour chaque étape de chaque process, et pour chaque danger identifié, l’(les) éventuel(s) CCP. La méthode utilisée doit être documentée (arbre de décision). Chaque CCP devra faire l’objet d’une surveillance, dont les résultats doivent être enregistrés. (cf. 6.1.1). L’ensemble des mesures de maîtrise appliqué au niveau d’un CCP devront être validées. (cf. 5.4).
- A
- B
- C
- D
- NA
- NE
5.3.5 DÉPLOIEMENT DE LA MÉTHODE HACCP - Établir les limites critiques pour chaque CCP
-
Des limites critiques doivent être déterminées pour la surveillance établie pour chaque CCP. Ces limites critiques doivent être mesurables et permettre d’apprécier de manière fiable la bonne réalisation de l’étape.
- A
- B
- C
- D
- NA
- NE
5.3.6 DÉPLOIEMENT DE LA MÉTHODE HACCP - Gestion des mesures de maîtrise (KO)
-
PLAN HACCP (planification) Un plan HACCP devra centraliser l’ensemble des CCP du process. Pour chacun d’eux, il précisera : - La (les) mesure(s) de maîtrise, - La (les) modalité(s) de surveillance (paramètre surveillé, périodicité), - La (les) limite(s) critique(s), - Le responsable de l’opération de surveillance, - La correction en cas de dépassement de la (des) limite(s) critique(s).
- A
- B
- C
- D
- NA
- NE
-
PLAN BPH (planification) La maîtrise de chaque étape peut être assurée par des mesures de maîtrise non spécifiques ou Bonnes Pratiques d’Hygiène ; maîtrise totale, ou partielle pour les CCP qui nécessitent une (des) mesure(s) de maîtrise spécifique(s). Les BPH sont par exemple des mesures générales concernant l’hygiène du personnel, ou l’environnement de travail. Ces mesures de maîtrise non spécifiques doivent être listées dans un document récapitulatif (« plan BPH ») et faire l’objet d’une vérification appropriée quant à leur bonne mise en œuvre. Ce document doit préciser pour chaque étape du process : - La (les) mesure(s) de maîtrise, - Les modalités de vérification de sa bonne mise en œuvre (méthode, périodicité), - Les éventuelles modalités de vérification de l’efficacité des mesures de maîtrise (méthode, périodicité), - Le(s) responsable(s) des opérations de vérification.
- A
- B
- C
- D
- NA
- NE
5.4.0 VALIDATION DES PROCESS EN CONTINU
-
Les process de production, fabrication ou transformation aboutissant à délivrance de produits ne pouvant pas être vérifiés pour une mesure a posteriori (contrôle libératoire) doivent être validés. Cette validation doit démontrer l’aptitude du process à atteindre les objectifs de sécurité, notamment à travers une étude initiale de validation comprenant les résultats permettant d’approuver le bon niveau de qualification du personnel, l’adéquation des équipements et l’utilisation des méthodes et procédures appropriées. A l'occasion de la validation des process, les mesures de maîtrise spécifiques appliquées au niveau des CCP, devront être validées. Les résultats de ces validations doivent être enregistrés.
- A
- B
- C
- D
- NA
- NE
-
Toute modification du process doit donner lieu à une nouvelle validation.
- A
- B
- C
- D
- NA
- NE
Ressources Humaines
4.1.3 Responsabilité des autres intervenants (suite)
-
Le secret médical doit être observé par tout le personnel.
- A
- B
- C
- D
- NA
- NE
4.4 MANAGEMENT DES RESSOURCES HUMAINES
-
Déterminer les compétences nécessaires pour le personnel effectuant un travail ayant une incidence sur la qualité des produits thermaux (couverts par le champ de l’HACCP)
- A
- B
- C
- D
- NA
- NE
-
Pourvoir à la formation (en interne ou en externe) pour acquérir ces compétences
- A
- B
- C
- D
- NA
- NE
-
Evaluer l’efficacité des actions de formation
- A
- B
- C
- D
- NA
- NE
-
S’assurer du maintien des compétences
- A
- B
- C
- D
- NA
- NE
-
S'assurer que les membres de son personnel ont conscience de l’impact de leurs activités et de la manière dont il contribue à la bonne qualité des produits et process.
- A
- B
- C
- D
- NA
- NE
-
Conserver les enregistrements appropriés (formation initiale et professionnelle, savoir-faire, expérience) concernant le suivi de la compétence du personnel.
- A
- B
- C
- D
- NA
- NE
5.2.1 PRÉPARATION AU DÉPLOIEMENT HACCP - Constituer l'équipe HACCP (KO)
-
La méthode HACCP doit être mise en œuvre par une équipe pluridisciplinaire réunissant des compétences méthodologiques, techniques, scientifiques et règlementaires. Des enregistrements doivent être conservés, attestant des connaissances et de l’expérience de l’équipe HACCP.
- A
- B
- C
- D
- NA
- NE
Achats
5.1.0 PROCESSUS D'ACHATS
-
L’établissement doit évaluer et sélectionner les fournisseurs selon des exigences établies (cahier des charges produit, cahier des charges fournisseur,…).
- A
- B
- C
- D
- NA
- NE
5.1.1 Informations relatives aux achats
-
Les informations relatives aux achats doivent décrire les produits achetés couverts par le champ de l’étude HACCP. Ces informations peuvent porter sur : - l’acceptabilité des produits et des procédures de surveillance, de mise à disposition et de retrait éventuel en rapport avec leur utilisation ; - la qualification du personnel externe (sous traitants, fournisseurs) intervenant dans l’établissement ; - le système de management de la qualité des sous-traitants et fournisseurs ; - ... etc. Ces exigences doivent être définies et approuvées par les personnes compétentes avant d’être transmises aux fournisseurs.
- A
- B
- C
- D
- NA
- NE
5.1.2 Vérification du produit acheté
-
L’établissement doit établir et mettre en œuvre des procédures de contrôle afin d’assurer que le produit acheté est conforme aux exigences d’achat spécifiées.
- A
- B
- C
- D
- NA
- NE
Réalisation des Soins et hygiène (visite)
4.1.2 Responsabilités du corps médical (suite)
-
Le diplôme de chaque médecin doit être consultable sur demande d’un curiste, ou communiqué par voie d’affichage.
- A
- B
- C
- D
- NA
- NE
4.1.3 Responsabilité des autres intervenants (suite)
-
Le diplôme d’Etat de l’infirmier doit être consultable sur demande d’un curiste, ou communiqué dans l’infirmerie par voie d’affichage.
- A
- B
- C
- D
- NA
- NE
-
Les surveillants qualifiés chargés de veiller à l’application exacte des traitements prescrits doivent être affectés à chaque service ou groupe de services.
- A
- B
- C
- D
- NA
- NE
-
Le personnel doit posséder des connaissances techniques suffisantes pour que soit assurée l’application correcte des traitements prescrits, et suivre des formations continues le cas échéant.
- A
- B
- C
- D
- NA
- NE
4.5.1 INFORMATION AU PERSONNEL ET AUX CURISTES - Obligation d'affichage (Etablissements thermaux ou exploitants de buvettes thermales uniquement)
-
Le responsable de l'établissement thermal doit afficher les éléments d'information des curistes et du personnel intervenant dans l'établissement. Pour l’eau minérale naturelle, cet affichage indique notamment : - les qualités thérapeutiques de l'eau minérale naturelle utilisée et ses éventuelles restrictions d'usage ; - les caractéristiques essentielles de l'eau ; - le cas échéant, le traitement mis en œuvre ; - le cas échéant, le réchauffage ou le refroidissement de l'eau ; - la date du dernier contrôle sanitaire et les résultats des analyses.
- A
- B
- C
- D
- NA
- NE
5.3.6 DÉPLOIEMENT DE LA MÉTHODE HACCP - Gestion des mesures de maîtrise (KO)
-
PLAN BPH SOINS ET HYGIENE (mise en oeuvre effective) La maîtrise de chaque étape peut être assurée par des mesures de maîtrise non spécifiques ou Bonnes Pratiques d’Hygiène ; maîtrise totale, ou partielle pour les CCP qui nécessitent une (des) mesure(s) de maîtrise spécifique(s). Les BPH sont par exemple des mesures générales concernant l’hygiène du personnel, ou l’environnement de travail. Ces mesures de maîtrise non spécifiques doivent être listées dans un document récapitulatif (« plan BPH ») et faire l’objet d’une vérification appropriée quant à leur bonne mise en œuvre. Ce document doit préciser pour chaque étape du process : - La (les) mesure(s) de maîtrise, - Les modalités de vérification de sa bonne mise en œuvre (méthode, périodicité), - Les éventuelles modalités de vérification de l’efficacité des mesures de maîtrise (méthode, périodicité), - Le(s) responsable(s) des opérations de vérification.
- A
- B
- C
- D
- NA
- NE
5.5.1 MAÎTRISE DES PROCESS - Identification et traçabilité (KO)
-
Lorsque cela est approprié, l’organisme doit identifier les produits à l’aide de moyens adaptés tout au long de sa réalisation et de son utilisation. La traçabilité passe par la maîtrise et l’enregistrement du produit identifié.
- A
- B
- C
- D
- NA
- NE
-
Lorsque cela est approprié (lot de boue, cataplasmes… etc.), l’organisme doit établir et appliquer un système de traçabilité qui permet d’identifier les lots de produits et leur relation avec les lots de matières premières ainsi que les enregistrements permettant d’identifier les usagers ayant été en contact avec le produit.
- A
- B
- C
- D
- NA
- NE
-
Les enregistrements relatifs à la traçabilité doivent être conservés pendant une durée définie suffisamment longue pour permettre l’information adaptée des usagers.
- A
- B
- C
- D
- NA
- NE
Exploitation et maintenance
5.3.6 DÉPLOIEMENT DE LA MÉTHODE HACCP - Gestion des mesures de maîtrise (KO)
-
PLAN HACCP (mise en oeuvre effective) Un plan HACCP devra centraliser l’ensemble des CCP du process. Pour chacun d’eux, il précisera : - La (les) mesure(s) de maîtrise, - La (les) modalité(s) de surveillance (paramètre surveillé, périodicité), - La (les) limite(s) critique(s), - Le responsable de l’opération de surveillance, - La correction en cas de dépassement de la (des) limite(s) critique(s).
- A
- B
- C
- D
- NA
- NE
-
PLAN BPH TECHNIQUE (mise en oeuvre effective) La maîtrise de chaque étape peut être assurée par des mesures de maîtrise non spécifiques ou Bonnes Pratiques d’Hygiène ; maîtrise totale, ou partielle pour les CCP qui nécessitent une (des) mesure(s) de maîtrise spécifique(s). Les BPH sont par exemple des mesures générales concernant l’hygiène du personnel, ou l’environnement de travail. Ces mesures de maîtrise non spécifiques doivent être listées dans un document récapitulatif (« plan BPH ») et faire l’objet d’une vérification appropriée quant à leur bonne mise en œuvre. Ce document doit préciser pour chaque étape du process : - La (les) mesure(s) de maîtrise, - Les modalités de vérification de sa bonne mise en œuvre (méthode, périodicité), - Les éventuelles modalités de vérification de l’efficacité des mesures de maîtrise (méthode, périodicité), - Le(s) responsable(s) des opérations de vérification.
- A
- B
- C
- D
- NA
- NE
5.5.2 MAÎTRISE DES PROCESS - Maîtrise des dispositifs de surveillance et de mesure
-
"L'organisme doit déterminer les dispositifs et les procédures de surveillance et de mesure nécessaires pour apporter la preuve de la conformité des produits. D’une manière générale la maîtrise décrite ci-après doit porter sur les équipements permettant de démontrer la maîtrise d’un CCP (surveillance) ou la conformité d’un paramètre réglementaire."
- A
- B
- C
- D
- NA
- NE
-
Pour assurer la validité des résultats, les équipements de mesure doivent être vérifiés en interne ou en externe.
- A
- B
- C
- D
- NA
- NE
-
L’organisme doit évaluer et enregistrer la validité des résultats de mesures antérieures lorsqu’un équipement se révèle non conforme aux exigences. L’organisme doit entreprendre les actions appropriées sur l’équipement et sur tout produit affecté.
- A
- B
- C
- D
- NA
- NE
-
Les enregistrements des résultats d’étalonnage et de vérification doivent être conservés.
- A
- B
- C
- D
- NA
- NE
6.2.1 SURVEILLANCE ET VÉRIFICATION - Établir un système de surveillance pour chaque CCP
-
Pour chaque CCP, un système de surveillance doit être établi visant à démontrer que ce dernier est maîtrisé. Ce système doit inclure tous les mesurages ou observations programmés relatifs à la (aux) limite(s) critique(s). Le système de surveillance doit être constitué de modes opératoires, d’instructions et d’enregistrements pertinents couvrant les points suivants : - les mesurages ou observations fournissant des résultats dans un intervalle de temps approprié ; - les dispositifs de surveillance utilisés ; - les méthodes d’étalonnage applicables ; - la fréquence de surveillance ; - la responsabilité et l’autorité associées à la surveillance et à l’évaluation des résultats de la surveillance ; - les exigences et les méthodes en matière d’enregistrement. Les méthodes et la fréquence de surveillance doivent permettre de déterminer à temps le dépassement des limites critiques, afin, si possible, d’isoler le produit avant son utilisation.
- A
- B
- C
- D
- NA
- NE
6.2.2 SURVEILLANCE ET VÉRIFICATION - Établir les corrections
-
Les corrections immédiates (actions curatives) à entreprendre lorsque les limites critiques sont dépassées doivent être spécifiées dans le plan HACCP. Les actions doivent garantir que le(s) paramètre(s) maîtrisé(s) au niveau du CCP est (sont) de nouveau maîtrisé(s) et que sa (leur) réapparition est évitée.
- A
- B
- C
- D
- NA
- NE
Conformité des produits
4.5.2 INFORMATION AU PERSONNEL ET AUX CURISTES - Gestion des alertes
-
L’établissement doit procéder à une information immédiate des usagers, assortie des conseils adaptés lorsque les limites de qualité fixées pour les produits thermaux et/ou leurs dérivés ne sont pas respectées.
- A
- B
- C
- D
- NA
- NE
-
En cas de dépassement des limites de qualités fixées pour l’eau minérale naturelle, l’établissement thermal doit informer immédiatement le directeur général de l’ARS qui transmet l'information au préfet. Il doit effectuer immédiatement une enquête afin de déterminer la cause du dépassement des limites de qualité et de porter sans délai à la connaissance du préfet les constatations et les conclusions de l'enquête. Enfin, l’établissement thermal doit informer le directeur général de l’ARS des mesures prises pour supprimer la cause du dépassement des limites de qualité. Le directeur général transmet ces informations au préfet avec ses observations. La mise en oeuvre effective du processus de gestion des alertes décrit ci-dessus doit pouvoir être démontrée.
- A
- B
- C
- D
- NA
- NE
6.2.4 SURVEILLANCE ET VÉRIFICATION - Vérification du produit (vérification de l’efficacité des mesures de maîtrise)
-
Un plan d'échantillonnage devra être défini par l’organisme pour chaque produit thermal considéré (EMN, boues, gaz / vapeurs / air comprimé et/ou compressé, eaux mères) dans le respect des exigences réglementaires applicables.
- A
- B
- C
- D
- NA
- NE
6.3.0 MAÎTRISE DU PRODUIT NON CONFORME (KO)
-
L'organisme doit s'assurer que le produit non conforme est identifié et maîtrisé de manière à empêcher son utilisation. L'organisme doit traiter le produit non conforme immédiatement.
- A
- B
- C
- D
- NA
- NE
-
Les contrôles, les responsabilités et autorités associées pour le traitement des produits non conformes, ainsi que les critères de non-conformités pour chaque type de produit, doivent être définis.
- A
- B
- C
- D
- NA
- NE
-
Il convient, pour les autres produits et dérivés thermaux (boues, gaz…), de se référer aux limites de sécurité sanitaire proposées dans le GBPTh.
- A
- B
- C
- D
- NA
- NE
-
Une communication appropriée aux autorités compétentes et aux usagers doit être mise en place suivant les procédures établies.
- A
- B
- C
- D
- NA
- NE
-
Les enregistrements de la nature des non conformités et de toutes actions ultérieures entreprises, y compris les dérogations obtenues, doivent être conservés.
- A
- B
- C
- D
- NA
- NE
-
Lorsqu’un produit non conforme est corrigé, il doit être vérifié de nouveau pour démontrer sa conformité aux exigences.
- A
- B
- C
- D
- NA
- NE
-
Lorsqu’un produit est détecté non conforme après sa livraison ou son utilisation, l’établissement doit mener les actions adaptées aux effets, réels ou potentiels, de la non-conformité.
- A
- B
- C
- D
- NA
- NE
Qualité et Amélioration continue
4.2.0 MAÎTRISE DES DOCUMENTS
-
Une procédure doit être établie pour : - définir les responsabilités pour rédiger, approuver, revoir et mettre à jour tout document avant diffusion ; - assurer que, lorsque les documents sont modifiés par rapport à la version précédente, les modifications et la version en vigueur des documents sont identifiées ; - assurer la disponibilité sur les postes de travail des versions à jour, lisibles et facilement identifiables ; - assurer que les documents extérieurs à l’organisme (informations techniques, données d’achat,…) sont identifiés et que leur diffusion est maîtrisée ; - retirer toutes les versions périmées des documents de l’ensemble des points de diffusion, les archives suivant une procédure établie et les identifier de manière adéquate si elles sont conservées dans un but précis.
- A
- B
- C
- D
- NA
- NE
4.3.0 MAÎTRISE DES ENREGISTREMENTS
-
Une procédure doit être établie pour assurer l’identification, le stockage, la protection, l’accessibilité, la durée de conservation et l’élimination des enregistrements.
- A
- B
- C
- D
- NA
- NE
6.1.0 ANALYSE DE LA CONFORMITÉ RÉGLEMENTAIRE
-
Le respect de l’ensemble des dispositions prévues dans le code de la santé publique relatives aux eaux minérales naturelles exploitées à des fins thérapeutiques dans un établissement thermal (procédure d’autorisation d’exploiter une eau minérale naturelle, conditions d’exploitation…) est un pré requis à la certification AQUACERT HACCP Thermalisme. L’établissement doit établir, mettre en œuvre et tenir à jour une (des) procédure(s) pour évaluer périodiquement sa conformité aux exigences légales applicables relatives à la sécurité sanitaire des produits et dérivés thermaux. Cette évaluation devra notamment être réalisée préalablement à l’analyse de dangers. L’établissement doit conserver des enregistrements des résultats de ces évaluations périodiques. De plus, un dispositif de veille réglementaire efficace doit être mis en œuvre et maintenu afin de s’assurer de l’identification des exigences légales applicables.
- A
- B
- C
- D
- NA
- NE
6.2.3 SURVEILLANCE ET VÉRIFICATION - Vérification de la mise en œuvre des mesures de maîtrise
-
Les vérifications nécessaires pour l’évaluation de la bonne application des mesures de maîtrise seront gérées dans le cadre des audits internes du système.
- A
- B
- C
- D
- NA
- NE
-
Les enregistrements des activités de vérification doivent être conservés.
- A
- B
- C
- D
- NA
- NE
7.1.0 AMÉLIORATION CONTINUE
-
L’organisme doit améliorer en permanence l’efficacité du système de management de la sécurité des produits et/ou dérivés thermaux.
- A
- B
- C
- D
- NA
- NE
7.2.0 AUDIT INTERNE (KO)
-
L’organisme doit mener des audits internes pour déterminer si le système de management de la sécurité des produits et/ou dérivés thermaux est conforme aux exigences établies par l’établissement et mis en œuvre et entretenu de manière efficace.
- A
- B
- C
- D
- NA
- NE
-
Une procédure documentée doit être établie pour définir les responsabilités et les exigences pour planifier, mener les audits, rendre compte des résultats et conserver des enregistrements des rapports d’audit et des actions correctives ou préventives issues de l’audit.
- A
- B
- C
- D
- NA
- NE
7.3.0 ACTIONS CORRECTIVES
-
L’organisme doit mener des actions adaptées pour éliminer les non conformités, ainsi que leurs causes afin d’éviter qu’elles ne se reproduisent. Une procédure doit être établie afin de définir les exigences pour : - procéder à la revue des non-conformités (y compris les réclamations); - déterminer les causes de non-conformités ; - déterminer les actions à entreprendre pour que les non-conformités ne se reproduisent pas ; - enregistrer les résultats des actions mises en œuvre ; - évaluer l’efficacité des actions réalisées.
- A
- B
- C
- D
- NA
- NE
7.4.0 ACTIONS PRÉVENTIVES
-
L’organisme doit déterminer les actions adaptées permettant d’éliminer les causes de non conformités potentielles. Une procédure doit être établie afin de définir les exigences pour : - déterminer les non conformités potentielles et leurs causes ; - déterminer les actions à entreprendre pour éviter l’apparition de non conformités ; - enregistrer les résultats des actions mises en œuvre ; - évaluer l’efficacité des actions réalisées.
- A
- B
- C
- D
- NA
- NE
Laboratoire d'analyse
-
Un laboratoire interne d'analyse est-il intégré au périmètre ?
-
Ledit laboratoire est-il accrédité selon ISO 17025 ?
-
Ledit laboratoire réalise-t-il des analyses au titre de la partie principale de la surveillance ?
-
L'établissement thermal auquel est rattaché le laboratoire certifie que l'encadrement et le personnel du laboratoire, réalisant les prélèvements et les analyses, ne sont soumis à aucune pression commerciale ou financière indue, susceptible de mettre en cause la qualité des travaux réalisés.
-
Le laboratoire participe à ses frais, au moins deux fois par an et, le cas échéant, sur demande dûment motivée du préfet ou du ministre chargé de la santé, à des essais interlaboratoires pour toutes les analyses des paramètres concernés pour la surveillance réalisée au titre de la PPS. Ces essais sont effectués auprès d'organismes d'essais interlaboratoires répondant aux règles du COFRAC ou de tout autre organisme d'accréditation équivalent européen signataire de l'accord multilatéral pris dans le cadre de la coordination européenne des organismes d'accréditation.
-
Le laboratoire n'est pas soumis aux exigences de l'Arrêté du 12 février 2007 relatif aux conditions auxquelles doivent satisfaire les laboratoires réalisant les prélèvements et les analyses de surveillance des eaux en application des articles R. 1321-24 et R. 1322-44 du code de la santé publique.
-
Joindre l'attestation/certificat d'accréditation
-
La présente grille ne constitue pas à ce jour une liste d'exigences opposables dont l'évaluation compte dans le score final permettant d'attribuer la certification. Elle regroupe toutefois des recommandations techniques et organisationnelles pertinentes pour le laboratoire audité et l'auditeur.
1. Personnel
-
Le responsable du laboratoire doit assurer la compétence de tous ceux qui assurent le fonctionnement d'appareils spécifiques, effectuent des analyses microbiologiques de l’eau minérale naturelle, évaluent les résultats et signent les rapports d’analyse. Lorsqu'il est fait appel à des collaborateurs qui sont en cours de formation, une supervision appropriée doit être prévue. Le personnel qui effectue des tâches spécifiques doit être qualifié sur la base d'un niveau d'études, d'une formation, d'une expérience appropriée et/ou de compétences démontrées, selon ce qui est exigé.
-
Le responsable du laboratoire doit formuler les objectifs en ce qui concerne la formation initiale, la formation continue et les compétences du personnel du laboratoire. Le laboratoire doit disposer d'une procédure pour identifier les besoins en formation et assurer la formation du personnel. Le programme de formation doit correspondre aux tâches actuelles et aux tâches futures prévisibles du laboratoire. L'efficacité des actions de formation mises en oeuvre doit être évaluée.
-
Le laboratoire doit avoir recours à des collaborateurs qui sont employés par le laboratoire ou sont sous contrat avec lui. Lorsqu'il est fait appel à du personnel technique et de soutien en position clé, que ce soit sous contrat ou à titre supplémentaire, le laboratoire doit assurer que ces collaborateurs sont supervisés, qu'ils sont compétents et qu'ils travaillent conformément aux exigences du présent référentiel.
-
Le laboratoire doit tenir à jour des descriptions de fonctions pour son personnel.
2. Installations et conditions ambiantes
-
Les installations d'analyses microbiologiques de l’eau minérale naturelle du laboratoire, y compris, mais non exclusivement, les sources d'énergie, l'éclairage et les conditions ambiantes, doivent permettre de faciliter une exécution correcte des analyses.
-
Le laboratoire doit assurer que les conditions ambiantes ne sont pas susceptibles d'invalider les résultats ou de compromettre la qualité requise de tout mesurage. Les exigences techniques relatives aux installations et aux conditions ambiantes susceptibles d'affecter les résultats des analyses doivent être consignées par écrit.
-
Le laboratoire doit surveiller, maîtriser et enregistrer les conditions ambiantes lorsqu'elles influencent la qualité des résultats. Par exemple, l'attention qui convient doit être portée à la stérilité biologique des accessoires, surfaces et conditions ambiantes, à la poussière, à l'humidité, à la température. Les analyses doivent être arrêtées lorsque les conditions ambiantes ont pour effet d'hypothéquer les résultats des analyses microbiologiques de l’eau minérale naturelle.
-
Les secteurs voisins où se déroulent des activités incompatibles doivent être effectivement séparés dans le temps ou dans l’espace (par exemple : analyses de limons, argiles, boues maturées, etc.). Des mesures doivent être prises pour prévenir la contamination.
-
L'accès aux secteurs influant sur la qualité des analyses microbiologiques de l’eau minérale naturelle et leur utilisation doit être réglementé.
-
Des mesures doivent être prises pour assurer le nettoyage et désinfection périodique des espaces et des surfaces de travail. A cet effet, un plan d’hygiène doit être établi et formalisé. Les enregistrements des opérations de nettoyages et de désinfections doivent être conservés.
3. Méthodes d'analyses de l’eau minérale naturelle
-
Le laboratoire doit utiliser les méthodes normalisées en vigueur pour l’analyse microbiologique de l’eau. L’utilisation de ces méthodes doit être respectée pour les étapes de prélèvement, manutention, transport, stockage et analyse en laboratoire.
-
Le laboratoire doit avoir des instructions pour l'utilisation et le fonctionnement de tous les appareils pertinents, et pour la manutention et la préparation des échantillons d’eau minérale naturelle. Toutes les instructions, normes, manuels et données de référence se rapportant aux travaux du laboratoire doivent être tenues à jour et être facilement accessibles au personnel (voir 4.2 et 4.3).
-
NOTE Il n'est pas nécessaire de compléter ou de récrire sous forme de procédures internes des normes internationales, régionales, nationales ou autres spécifications reconnues contenant des informations suffisantes et concises sur la manière d'effectuer les analyses microbiologiques de l’eau minérale naturelle, si ces normes sont rédigées sous une forme utilisable telle quelle par le personnel d'exploitation d'un laboratoire. Il peut se révéler nécessaire de fournir une documentation supplémentaire pour des étapes facultatives de la méthode ou des détails complémentaires.
4. Maîtrise des données
-
L’utilisation de logiciels développés en interne ou en externe pour le traitement des résultats d’analyses, l’expression des résultats et l’édition d’un bulletin d’analyse doivent être vérifiés et validés.
5. Equipements
-
Les équipements requis dans les méthodes normalisées, appliquées par le laboratoire, doivent être disponibles.
-
Des programmes d'étalonnage doivent être établis pour les équipements et instruments influençant la qualité des résultats. Avant d'être mis en service, les équipements et instruments doivent être étalonnés ou vérifiés afin d'établir qu'ils répondent aux exigences spécifiées du laboratoire et qu'ils sont conformes aux spécifications normatives. Ils doivent être également contrôlés avant utilisation.
-
L'équipement doit être utilisé par un personnel autorisé. Des instructions à jour concernant l'utilisation et l'entretien de l'équipement (y compris tout manuel approprié fourni par le fabricant) doivent être facilement accessibles au personnel approprié du laboratoire.
-
Les instruments et équipements ayant une influence significative pour le résultat doivent être identifiés de façon unique.
-
Il faut établir des enregistrements de chaque élément d'équipement (et son logiciel correspondant si applicable) ayant une incidence sur les analyses d’eau minérale naturelle effectuées. Les enregistrements doivent inclure au moins ce qui suit :<br>a) l'identité de l'élément d'équipement (et de son logiciel correspondant si applicable);<br>b) le nom du fabricant, l'identification de type et le numéro de série ou autre identification unique;<br>c) les vérifications de la conformité de l'équipement aux spécifications;<br>d) son emplacement actuel, le cas échéant;<br>e) les instructions du fabricant, si elles sont disponibles, ou les coordonnées du lieu où elles se trouvent;<br>f) les dates, les résultats et les copies de rapports et de certificats de l'ensemble des étalonnages, ajustages, critères d'acceptation et date prévue du prochain étalonnage;<br>g) le plan de maintenance, s'il y a lieu, et l'entretien effectué à ce jour;<br>h) tous les dégâts, dysfonctionnements, modifications ou réparations de l'équipement.
-
Le laboratoire doit disposer de procédures pour la manutention, le transport, le stockage, l'utilisation et la maintenance planifiée des instruments de mesure afin d'en assurer le fonctionnement correct et de prévenir toute contamination ou détérioration.
-
Un équipement qui a été l'objet d'une surcharge ou d'une mauvaise manutention, qui donne des résultats suspects ou qui s'est révélé défectueux ou hors des limites spécifiées, doit être mis hors service. Il doit être isolé afin d'empêcher son utilisation ou être clairement étiqueté ou marqué comme étant hors service jusqu'à ce qu'il ait été réparé et qu'un étalonnage ou une analyse ait montré qu'il fonctionne correctement. Le laboratoire doit examiner l'effet de la défaillance ou de l'écart par rapport aux limites spécifiées sur des analyses antérieurs et doit instituer la procédure de «maîtrise des analyses non conformes».
-
Tout équipement sous contrôle du laboratoire et exigeant un étalonnage doit être étiqueté, codé ou autrement identifié pour indiquer le statut de l'étalonnage, ainsi que la date d'étalonnage et la date ou les critères d'échéance du prochain étalonnage.
-
Lorsque, pour une raison quelconque, un équipement échappe au contrôle direct du laboratoire, le laboratoire doit assurer que l'état de fonctionnement et le statut de l'étalonnage sont vérifiés et jugés satisfaisants avant de remettre l'équipement en service.
-
Les équipements doivent être protégés contre des réglages qui invalideraient les résultats d’analyse.
6. Traçabilité du mesurage
-
Tout équipement utilisé pour effectuer des analyses, y compris les instruments servant aux mesurages annexes (par exemple des conditions ambiantes), ayant un effet significatif sur l'exactitude ou la validité du résultat d’analyse, doit être étalonné avant d'être mis en service. Le laboratoire doit avoir un programme et une procédure établis pour l'étalonnage de son équipement.
-
Le laboratoire doit avoir un programme et une procédure pour l'étalonnage de ses étalons de référence. Les étalons de référence doivent être étalonnés par un organisme capable de fournir la traçabilité.
-
Le laboratoire doit avoir des procédures pour la manutention , le transport, le stockage et l'utilisation des étalons de référence afin de prévenir toute contamination ou détérioration et afin d'en préserver l'intégrité.
7. Echantillonnage
-
Le laboratoire doit disposer d'un plan d'échantillonnage (plan de prélèvements) cohérent avec le plan H.A.C.CP. de l’établissement dont il assure la surveillance interne. Et également de procédures de prélèvements.
8. Manutention des échantillons d’eau minérale naturelle
-
Le laboratoire doit avoir des procédures pour le transport, la réception, la manutention, la protection, le stockage, la conservation et/ou l'élimination d’analyses.
-
Le laboratoire doit établir un système pour identifier les échantillons. L'identification doit être conservée durant toute la durée de vie de l'échantillon dans le laboratoire. Le système doit être conçu et géré de façon à garantir l'impossibilité de confondre les échantillons physiquement.
-
À la réception de l’échantillon, toute anomalie ou écart par rapport aux conditions normales ou spécifiées, telles qu'elles sont décrites dans la méthode d’analyse, doit être enregistrée. En cas de doute quant à l'adéquation d'un échantillon, ou si l'échantillon n'est pas conforme à la description fournie, ou encore si l’échantillon demandé n'est pas conforme aux exigences requises, celui-ci devra être refusé et détruit. Un enregistrement devra être conservé.
-
Le laboratoire doit disposer de procédures et d'installations appropriées pour éviter la détérioration, la perte ou l'endommagement de l’échantillon lors du stockage, de la manutention et de la préparation. Lorsque les échantillons sont stockés et conservés, la surveillance et l’enregistrement des températures doivent être assurés conformément aux méthodes normalisées en vigueurs.
9. Maitrise de la qualité des résultats d’analyse
-
Le laboratoire doit disposer de procédures de maîtrise de la qualité pour surveiller la validité des analyses. Les données résultantes doivent être enregistrées de telle sorte que les tendances sont détectables et, lorsque cela est faisable, des techniques statistiques doivent être appliquées à l'examen des résultats. Cette surveillance doit être planifiée et revue et peut inclure, sans s'y limiter, les éléments suivants:<br>a) utilisation régulière de milieux stériles ou de souches pures certifiées;<br>b) participation à des programmes de comparaisons entre laboratoires;<br>c) analyses de re-contrôle sur échantillons conservés ;
-
Les données de maîtrise de la qualité (températures, analyses à blanc non-conformes, problèmes de fertilité des milieux, problèmes de qualité de l’air ambiant, etc.) doivent être analysées et, lorsqu'elles ne satisfont pas aux critères prédéfinis, une action programmée doit être prise pour corriger le problème et éviter de rapporter des résultats incorrects.
10. Rapports d’analyses
-
Les résultats de chaque analyse, effectuée par le laboratoire, doivent être rapportés de manière exacte, claire, non ambiguë, objective, et conformément aux instructions particulières données dans les méthodes normalisées d’analyse de l’eau.
-
Chaque rapport d’analyse doit comporter au moins les indications suivantes :<br>a) un titre (par exemple «Rapport d'analyse d’eau minérale naturelle»);<br>b) le nom et l'adresse du laboratoire ;<br>c) l'indication unique du rapport d’analyse (tel que le numéro de série) et, sur chaque page, une indication permettant d'assurer que la page est reconnue comme faisant partie du rapport d’analyse, avec une indication claire de la fin du rapport d'analyse;<br>d) le nom et l'adresse de l’établissement thermal ayant demandé l’analyse;<br>e) l'identification des méthodes employées;<br>f) la description, le conditionnement et l'identification non ambiguë de échantillon;<br>g) la date de réception de chaque échantillon soumis à analyse et la date d'exécution de chaque analyses réalisées sur l’échantillon;<br>h) les résultats de l’analyse avec, s'il y a lieu, les unités de mesure;<br>i) le (les) nom(s), fonction(s) et signature(s), ou une identification équivalente, de la (des) personne(s) autorisant le rapport d’analyse;
-
Outre les exigences répertoriées ci-dessus, les rapports d'analyse doivent inclure les éléments suivants, lorsque cela est nécessaire pour l'interprétation des résultats d'analyse:<br>a) les écarts, adjonctions ou suppressions par rapport à la méthode d'analyse, et une information relative aux conditions spécifiques de l'analyse, telles que les conditions ambiantes;<br>b) s'il y a lieu, une déclaration de conformité/de non-conformité aux exigences et/ou spécifications;<br>c) lorsque c'est approprié et nécessaire, des avis et interprétations.
-
Outre les exigences répertoriées ci-dessus, les rapports d'analyse contenant les résultats de l'échantillonnage doivent comporter les points suivants lorsque cela est nécessaire à l'interprétation des résultats de l'analyse:<br>a) la date du/des prélèvement(s);<br>b) l'identification non ambiguë du lieu de prélèvement;<br>c) les détails sur toutes les conditions ambiantes durant l'échantillonnage susceptibles d'influencer l'interprétation des résultats des analyses;
11. Résultats d'analyses obtenus auprès de sous-traitants
-
Lorsque le rapport d'analyse contient des résultats d'analyses effectués par des sous-traitants, ces résultats doivent être clairement indiqués. Le sous-traitant doit rapporter les résultats par écrit ou sous forme électronique.
12. Transmission électronique des résultats
-
En cas de transmission des résultats d'analyse ou d'étalonnage par téléphone, télex, télécopie ou autres moyens électroniques ou électromagnétiques, les exigences du présent référentiel en matière de maitrise des informations documentées s'appliquent.
13. Maîtrise des analyses non-conformes
-
Le laboratoire doit avoir une politique et des procédures qui doivent être mises en oeuvre lorsqu'un aspect quelconque de ses travaux d'analyse et/ou d'étalonnage, ou le résultat de ces travaux, ne sont pas conformes à ses propres procédures ou aux exigences convenues du client. La politique et les procédures doivent assurer que : <br>a) les responsabilités et autorisations pour la gestion des travaux non conformes sont attribuées et que les actions requises (y compris l'arrêt des travaux et la rétention des rapports d'analyse et des certificats d'étalonnage, s'il y a lieu) sont définies et appliquées lorsque des travaux non conformes sont identifiés; <br>b) une évaluation de l'importance des travaux non conformes est effectuée; <br>c) une correction est prise immédiatement, ainsi que toute décision concernant l'acceptabilité des travaux non conformes <br>d) la responsabilité d'autoriser la poursuite des travaux est définie.
14. Revues du Système qualité du Laboratoire
-
Le responsable du laboratoire doit effectuer périodiquement, selon un calendrier et une procédure prédéterminés, une revue du système qualité et des activités d’analyse, pour assurer qu'ils demeurent constamment appropriés et efficaces, et pour introduire toute modification ou amélioration nécessaires. La revue doit tenir compte des éléments suivants:<br> résultats d'audits internes récents;<br> actions correctives et préventives;<br> évaluations effectuées par des organismes externes;<br> résultats d'essais de comparaison entre laboratoires ou d'essais d'aptitude;<br> tout changement dans le volume et le type de travail effectué;<br> informations en retour de l’établissement<br> recommandations pour l'amélioration;<br> tous autres facteurs pertinents, tels que les activités de maîtrise de la qualité, les ressources et la formation du personnel.
-
NOTE 1 La périodicité type d'une revue de direction est tous les 12 mois.
Mesures COVID 19
-
L'analyse de dangers a été revue pour prendre en compte le danger SARS-CoV-2.
-
Des mesures de maitrise du risque lié au SARS-CoV-2 ont été sélectionnées et planifiées dans l'établissement. L'établissement est capable de justifier qu'il a pris en compte le référentiel sanitaire du thermalisme du 28 mai 2020.
-
Le plan BPH a été mis à jour en tenant compte des mesures de maitrise du risque lié au SARS-CoV-2.
-
Le personnel a été formé au risque lié au SARS-CoV-2 et aux mesures de maitrise applicables.
-
Des mesures de maitrise du risque lié au SARS-CoV-2 sont réellement mises en oeuvre dans l'établissement.
-
La mise en oeuvre des mesures de maitrise du risque lié au SARS-CoV-2 est vérifiée périodiquement dans le cadre d'audits ou inspections internes.
Conclusion
-
Conclusion et recommandation à la certification
Personnel rencontré lors de l'audit
-
Liste des personnes rencontrées (nom et fonctions)